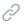北京大学王世强课题组发现心肌细胞横管膜形态发生的重要原理
8月10日,纳米科学重要期刊Nano Letters以“Nanobar array assay revealed complementary roles of BIN1 splice isoforms in cardiac T-tubule morphogenesis”为题,在线发表了北京大学生命科学学院王世强教授课题组与斯坦福大学崔便晓教授课题组合作取得的新发现——含有和不含磷脂酰肌醇结合域的两种BIN1剪切体通过功能互补的结构互作,形成心肌细胞整齐排列的横管膜结构。
心肌细胞的横管膜与肌质网膜平行排列,二者之间的钙信号耦联决定着心脏的泵血能力。横管膜形态异常与多数心脏疾病密切相关。然而横管膜形态发生与定位的分子机制一直未能阐明。
BIN1是一类具有香蕉形曲率的蛋白质分子。王世强的博士生韩晶、李琳琳、郭前进、梁景辉等在心肌细胞首次鉴定出带有磷脂酰肌醇结合域的BIN1剪切体pBIN1,并发现其表达产物会诱导新生鼠心肌细胞产生大量杂乱无章的管状膜结构。相反,缺少磷脂酰肌醇结合域的剪切体uBIN1表达于心肌细胞Z盘结构,但不能形成管状结构。
为了弄清不同BIN1剪切体的分子性质,王世强课题组与崔便晓课题组合作,在硅芯片上设计了具有不同曲率的条状纳米结构,并在其上培养表达不同BIN1剪切体的细胞。结果表明,pBIN1富集于高曲率的纳米条两端,而uBIN1弥散于细胞质。惊奇的是,当两类剪切体共表达时,uBIN1被pBIN1募集到纳米条高曲率的两端,而uBIN也能将pBIN1形成的管状膜结构铆定到心肌细胞的Z盘。
研究人员由此提出了横管膜形态发生和定位的嵌合理论:pBIN1通过与磷脂酰肌醇的结合组织细胞膜泡形成横管膜,并通过与uBIN的嵌合由uBIN1的SH3结构域铆定于Z盘(下图),形成与肌质网的结构耦联。

横管形态发生和定位的嵌合BIN1模型(吴昊迪博士绘制)
根据这一理论,pBIN1与uBIN1的剪切失衡将导致横管结构和功能异常,这一点在心肌梗塞模型中得到验证。相反,在心肌特异性过表达uBIN1的大鼠中,心肌梗塞对横管的影响较小,心脏收缩功能显著改善。因此,上述发现不仅揭示了控制心脏收缩功能的重要分子机制,也为认识和治疗心脏疾病提供了新理论、新思路。

本网站转载的文章版权归原文作者所有,如有侵权请联系我们删除。